彭飛/涂盈鋒AFM:光控微納米馬達(dá)精準(zhǔn)調(diào)節(jié)視網(wǎng)膜神經(jīng)節(jié)細(xì)胞活動(dòng)
發(fā)布時(shí)間:2021-10-12 08:40:28 人氣:1309
中山大學(xué)材料科學(xué)與工程學(xué)院彭飛副教授團(tuán)隊(duì)與南方醫(yī)科大學(xué)涂盈鋒教授團(tuán)隊(duì)在微納米馬達(dá)精確調(diào)節(jié)神經(jīng)元細(xì)胞活性領(lǐng)域取得了新的研究進(jìn)展。研究結(jié)果以“Photoelectrochemical TiO2-Au-Nanowire-Based Motor for Precise Modulation of Single-Neuron Activities(基于光電化學(xué)TiO2-Au納米線馬達(dá)精確調(diào)節(jié)單個(gè)神經(jīng)元細(xì)胞活性)”為題,在國(guó)際科學(xué)期刊Advanced Functional Materials(DOI:10.1002/adfm.202008667) (IF=16.836)在線發(fā)表。該文主要開(kāi)發(fā)了一種基于馬達(dá)的神經(jīng)刺激策略,代表了一種精確、無(wú)創(chuàng)地傳遞生物電信號(hào)和調(diào)節(jié)神經(jīng)元活動(dòng)的新方法。
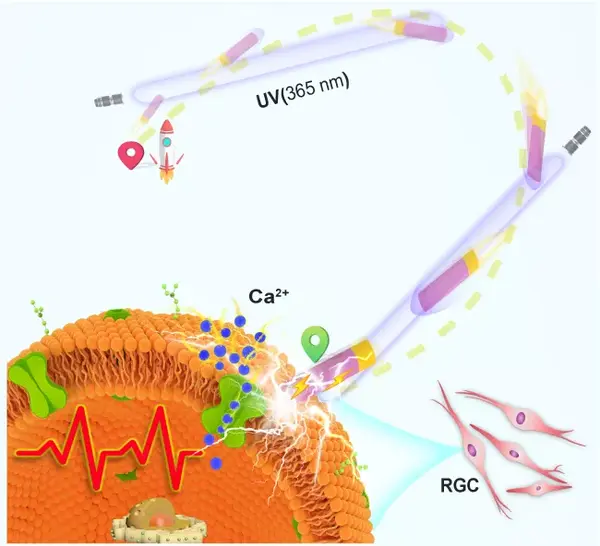
視覺(jué)損傷甚至失明一直是醫(yī)學(xué)治療的重大課題。視網(wǎng)膜神經(jīng)節(jié)細(xì)胞(RGCs)的輔助激活則有助于視覺(jué)信號(hào)轉(zhuǎn)導(dǎo)回路的恢復(fù)。據(jù)報(bào)道,人工光感受器產(chǎn)生的電刺激可以通過(guò)打開(kāi)鈣離子通道使細(xì)胞興奮。但目前人工光感受器材料體積龐大,需要手術(shù)植入,侵入性是一個(gè)不可避免的主要問(wèn)題,限制了它們?cè)谏矬w中的應(yīng)用。鑒于此,在神經(jīng)刺激領(lǐng)域還缺乏一種無(wú)創(chuàng)、高度可控的方法。
為了解決這一難題,團(tuán)隊(duì)展開(kāi)合作,成功地構(gòu)建并演示了由UV光(365 nm)驅(qū)動(dòng)TiO2-Au 納米線(NW)馬達(dá)利用固有產(chǎn)生的光電流實(shí)現(xiàn)目標(biāo)RGC的高精度激活。在UV光照射下,通過(guò)光電效應(yīng)和光化學(xué)水分解的協(xié)同作用,光電化學(xué)反應(yīng)下馬達(dá)的自電泳機(jī)制在整個(gè)TiO2-Au NW馬達(dá)上建立了局部電場(chǎng)。通過(guò)調(diào)節(jié)光的方向,可以驅(qū)動(dòng)馬達(dá)以高精度靶向到目標(biāo)RGC細(xì)胞。馬達(dá)自身產(chǎn)生的光電流隨后被傳輸并成功激活RGC細(xì)胞,從而實(shí)現(xiàn)了細(xì)胞與納米線之間的信號(hào)傳輸。由于NW的小尺寸和柔性以及良好的半導(dǎo)體性能,TiO2-Au馬達(dá)有效地實(shí)現(xiàn)了神經(jīng)刺激。高度可控的馬達(dá)的應(yīng)用也代表了一種以優(yōu)越的時(shí)空精度連接神經(jīng)系統(tǒng)的新方法。我們首次證明了馬達(dá)的光電轉(zhuǎn)換能力,除了提供驅(qū)動(dòng)力外,還可以產(chǎn)生生物電信號(hào)來(lái)調(diào)節(jié)神經(jīng)元活動(dòng),這對(duì)于實(shí)現(xiàn)精準(zhǔn)的、非侵入性的生物信號(hào)轉(zhuǎn)導(dǎo)以及與生物系統(tǒng)的通信具有重要意義。
中山大學(xué)材料科學(xué)與工程學(xué)院為本文第一單位。研究生陳彬為本文的第一作者。奈梅亨大學(xué)Daniela A. Wilson教授參與了本項(xiàng)研究,為論文的共同作者。
原文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202008667
本信息源自互聯(lián)網(wǎng)僅供學(xué)術(shù)交流 如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請(qǐng)以實(shí)物為主,如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除。 |
上一篇: 陰離子可以插入MXene嗎?


