新型智能載體-活性氧響應型脂質體通過調控腫瘤微環境增強光/化學動力學治療
發布時間:2021-06-22 19:56:06 人氣:2568
腫瘤微環境具有局部乏氧、同時具有較高濃度的還原性物質(如GSH)等特點,并因此限制了多種癌癥治療技術的療效。在新興的癌癥治療技術中,化學動力學治療(CDT)方法主要利用特定價態的金屬離子與過氧化氫(H2O2)之間的芬頓反應產生強氧化性羥基自由基,對腫瘤細胞進行殺傷,但由于腫瘤微環境微酸性(pH 6.5~7.0)不足,H2O2供應有限,GSH可能對羥基自由基的產生有抑制等因素,CDT治療效果受到影響。光動力學治療(PDT)方法的療效也會因為腫瘤病灶區域局部乏氧的特點大打折扣。因此,對腫瘤微環境進行調控和改造對高效癌癥治療十分關鍵,利用腫瘤微環境特征發展腫瘤微環境特異性激活的高效治療將具有積極意義。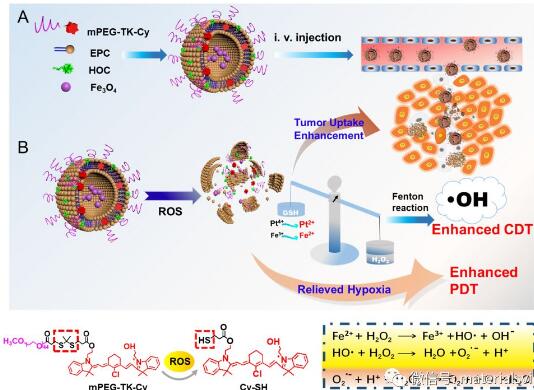
蘇州大學功能納米與軟物質研究院劉堅教授和中科院上海藥物研究所于海軍研究員合作報道了一種可被活性氧(ROS)激活的脂質體(RALP),應用于改造腫瘤微環境,協同增強PDT/CDT治療癌癥的療效。實驗設計的RALP@HOC@Fe3O4包含了對ROS有響應的硫酮鍵(thioketal bond)的脂質體,當與ROS發生化學反應而剪切斷鍵后,可有效增強藥物遞送體系在腫瘤細胞的穿透和攝取,并實現響應型的藥物釋放。共負載Fe3O4納米顆粒和奧沙利鉑前藥的RALP能消耗GSH,對腫瘤乏氧微環境進行改造增加了PDT的療效。當奧沙利鉑前藥(毒性較低)與腫瘤細胞內的GSH發生反應對其消耗的同時,生成了具有高毒性的奧沙利鉑可增加對腫瘤的殺傷。而GSH的消耗既可以避免PDT過程中ROS被過度湮滅,而且也可以調節腫瘤中的化學物種平衡以提高H2O2的產生,有助于和RALP中的Fe (II)發生芬頓反應生成羥基自由基以實現協同增強的CDT。該設計思路創新提出了調控腫瘤微環境進而協同增強PDT/CDT,采用的原料生物相容性好,療效在細胞和活體動物實驗中得到了良好驗證,具有臨床轉化前景
| 溫馨提示:蘇州北科納米供應產品僅用于科研,不能用于人體,不同批次產品規格性能有差異。網站部分文獻案例圖片源自互聯網,圖片僅供參考,請以實物為主,如有侵權請聯系我們立即刪除。 |
上一篇: 生物仿生結構材料


